 Pada tahun 1803, John Dalton mengemukakan mengemukakan pendapatnaya tentang atom. Teori atom Dalton didasarkan pada dua hukum, yaitu hukum kekekalan massa (hukum Lavoisier) dan hukum susunan tetap (hukum prouts).
Pada tahun 1803, John Dalton mengemukakan mengemukakan pendapatnaya tentang atom. Teori atom Dalton didasarkan pada dua hukum, yaitu hukum kekekalan massa (hukum Lavoisier) dan hukum susunan tetap (hukum prouts). Lavosier mennyatakan bahwa "Massa total zat-zat sebelum reaksi akan selalu sama dengan massa total zat-zat hasil reaksi". Sedangkan Prouts menyatakan bahwa "Perbandingan massa unsur-unsur dalam suatu senyawa selalu tetap". Dari kedua hukum tersebut Dalton mengemukakan pendapatnya tentang atom sebagai berikut:
- Unsur terbuat dari partikel-partikel kecil yang disebut atom.
- Semua atom dari suatu unsur adalah identik.
- Atom dari suatu unsur tertentu yang berbeda dari unsur lainnya; atom dari unsur-unsur yang berbeda dapat dibedakan dari satu sama lain dengan bobot relatif masing-masing.
- Atom dari satu elemen dapat menggabungkan dengan atom elemen lain untuk membentuk senyawa kimia; senyawa tertentu selalu memiliki jumlah relatif sama jenis atom.
- Atom tidak dapat diciptakan, dibagi menjadi partikel yang lebih kecil, juga hancur dalam proses kimia, sebuah reaksi kimia hanya mengubah cara atom dikelompokkan bersama.
Dalton mengusulkan tambahan "aturan paling sederhana" yang menciptakan kontroversi, karena tidak dapat secara independen dikonfirmasi.
Ini hanyalah sebuah asumsi, yang berasal dari iman dalam kesederhanaan alam. Tidak ada bukti yang kemudian tersedia bagi para ilmuwan untuk menyimpulkan berapa banyak atom dari setiap unsur bergabung untuk membentuk molekul senyawa. Tapi ini atau beberapa aturan seperti itu benar-benar diperlukan untuk setiap teori yang baru jadi, karena salah satu asumsi yang diperlukan rumus molekul untuk menghitung berat atom relatif. Dalam setiap kasus, Dalton menyimpulkan "peraturan terbesar dalam kesederhanaan" menyebabkan dia menganggap bahwa formula untuk air dan amonia adalah OH dan NH, sangat berbeda dari pengertian modern kita.
Yang pasti, keyakinan bahwa atom tidak dapat dibagi, dibuat, atau dihancurkan menjadi partikel yang lebih kecil ketika mereka digabungkan, dipisahkan, atau menata ulang dalam reaksi kimia tidak konsisten dengan adanya fusi nuklir dan fisi nuklir, tetapi proses tersebut adalah reaksi nuklir dan tidak reaksi kimia. Di samping itu, gagasan bahwa semua atom dari suatu unsur adalah identik dalam sifat fisik dan kimia tidak tepat benar, karena kita sekarang tahu bahwa berbeda isotop dari suatu unsur memiliki bobot yang berbeda-beda sedikit. Namun, Dalton telah menciptakan sebuah teori kekuasaan yang besar dan penting. Memang, inovasi Dalton sepenuhnya sama pentingnya bagi masa depan ilmu sebagai Laurent Antoine Lavoisier oksigen berbasis kimia dulu.
Hipotesa Dalton digambarkan dengan model atom sebagai bola pejal seperti pada tolak peluru. Lihat gambar di bawah.

Berbagai atom dan molekul seperti digambarkan dalam John Dalton's “A New System of Chemical Philosophy” (1808). Lihat gambar dibawah.
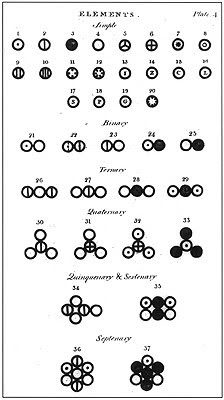
Unsur 1-20 pada gambar disamping merupakan mono- unsur (single element)
Unsur 21-25 pada gambar disamping merupakan di- unsur (binacy element)
Unsur 26-29 pada gambar disamping merupakan tri- unsur (tremacy element)
Unsur 30-33 pada gambar disamping merupakan tetra- unsur (quatermacy element)
Unsur 34 pada gambar disamping merupakan pentra- unsur (quingemacy element)
Unsur 35 pada gambar disamping merupakan hexta- unsur (sextemacy element)
Unsur 36-37 pada gambar disamping merupakan hepta- unsur (septemacy element)
Kelebihan dalam teori atom John Dalton
Mulai membangkitkan minat terhadap penelitian mengenai model atom
Kekurangan dalam teori atom John Dalton
Teori atom Dalton tidak dapat menerangkan suatu larutan dapat menghantarkan arus listrik. Bagaimana mungkin bola pejal dapat menghantarkan arus listrik? Padahal listrik adalah elektron yang bergerak. Berarti ada partikel lain (belakangan diketahui sebagai partikel subatomik) yang dapat menghantarkan arus listrik.
Dwi, hanya mengingatkan. Gambar 21-37 itu molekul dan belum tentu itu unsur (kebanyakan malahan senyawa)
BalasHapus