 Model atom mekanika kuantum dikembangkan oleh Erwin Schrodinger (1926).Sebelum Erwin Schrodinger, seorang ahli dari Jerman Werner Heisenberg mengembangkan teori mekanika kuantu
Model atom mekanika kuantum dikembangkan oleh Erwin Schrodinger (1926).Sebelum Erwin Schrodinger, seorang ahli dari Jerman Werner Heisenberg mengembangkan teori mekanika kuantu m yang dikenal dengan prinsip ketidakpastian yaitu “”. Model atom dengan orbital lintasan elektron disebut model atom modern atau model atom mekanika kuantum yang berlaku sampai saat ini.
m yang dikenal dengan prinsip ketidakpastian yaitu “”. Model atom dengan orbital lintasan elektron disebut model atom modern atau model atom mekanika kuantum yang berlaku sampai saat ini.model atom modern atau model atom mekanika kuantum seperti terlihat pada gambar berikut ini.
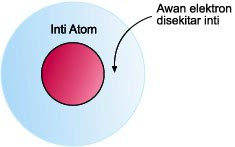 Awan elektron disekitar inti menunjukan tempat kebolehjadian elektron. Orbital menggambarkan tingkat energi elektron. Orbital-orbital dengan tingkat energi yang sama atau hampir sama akan membentuk sub kulit. Beberapa sub kulit bergabung membentuk kulit. Dengan demikian kulit terdiri dari beberapa sub kulit dan subkulit terdiri dari beberapa orbital. Walaupun posisi kulitnya sama tetapi posisi orbitalnya belum tentu sama. Maka, teori atom ini juga bisa disebut dengan orbital atom.
Awan elektron disekitar inti menunjukan tempat kebolehjadian elektron. Orbital menggambarkan tingkat energi elektron. Orbital-orbital dengan tingkat energi yang sama atau hampir sama akan membentuk sub kulit. Beberapa sub kulit bergabung membentuk kulit. Dengan demikian kulit terdiri dari beberapa sub kulit dan subkulit terdiri dari beberapa orbital. Walaupun posisi kulitnya sama tetapi posisi orbitalnya belum tentu sama. Maka, teori atom ini juga bisa disebut dengan orbital atom.Orbital atom adalah sebuah fungsi matematika yang menggambarkan gelombang-perilaku seperti salah satu elektron atau sepasang elektron, di dalam sebuah atom. Fungsi ini dapat digunakan untuk menghitung probabilitas menemukan setiap elektron dalam sebuah atom tertentu di daerah sekitar inti atom. Fungsi-fungsi ini dapat berfungsi sebagai grafik tiga-dimensi dari kemungkinan lokasi elektron. Istilah dengan demikian dapat merujuk langsung ke kawasan fisik didefinisikan oleh fungsi di mana elektron cenderung. Secara khusus, orbital atom adalah kemungkinan negara-negara kuantum elektron dari seorang individu dalam koleksi elektron di sekitar atom tunggal, seperti yang dijelaskan oleh fungsi orbital.
Meskipun jelas analogi untuk planet-planet berputar mengelilingi matahari, elektron tidak dapat digambarkan sebagai partikel padat dan orbital atom jarang, jika pernah, mirip lintasan elips planet. Yang lebih akurat mungkin analogi yang besar dan seringkali berbentuk aneh atmosfer (elektron), didistribusikan di planet yang relatif kecil (inti atom). Orbital atom tepat menggambarkan bentuk suasana ini hanya ketika sebuah elektron tunggal hadir dalam sebuah atom. Ketika lebih elektron yang ditambahkan ke sebuah atom, elektron tambahan cenderung lebih merata mengisi volume ruang di sekitar inti sehingga hasil pengumpulan (kadang-kadang disebut atom "elektron awan") cenderung ke arah yang umumnya zona bola probabilitas menggambarkan di mana elektron atom akan ditemukan.
Ciri khas model atom mekanika gelombang / orbital atom :
1. Gerakan elektron memiliki sifat gelombang, sehingga lintasannya (orbitnya) tidak stasioner seperti model Bohr, tetapi mengikuti penyelesaian kuadrat fungsi gelombang yang disebut orbital (bentuk tiga dimensi darikebolehjadian paling besar ditemukannya elektron dengan keadaan tertentu dalam suatu atom)
2. Bentuk dan ukuran orbital bergantung pada harga dari ketiga bilangan kuantumnya. (Elektron yang menempati orbital dinyatakan dalam bilangan kuantum tersebut)
3. Posisi elektron sejauh 0,529 Amstrong dari inti H menurut Bohr bukannya sesuatu yang pasti, tetapi bolehjadi merupakan peluang terbesar ditemukannya elektron.
Kelemahan pada teori atom modern ialah Persamaan gelombang Schrodinger hanya dapat diterapkan secara eksak untuk partikel dalam kotak dan atom dengan elektron tunggal.
Tidak ada komentar:
Posting Komentar