 Niels Henrik David Bohr (7 Oktober 1885 – 18 November 1962) adalah seorang fisikawan Denmark yang membuat kontribusi yang mendasar untuk memahami atom struktur dan mekanika kuantum, di mana ia menerima Penghargaan Nobel dalam Fisika pada tahun 1922. Bohr dibimbing dan berkolaborasi dengan banyak fisikawan top abad di institut di Kopenhagen. Ia juga bagian dari tim ahli fisika yang bekerja di Proyek Manhattan. Margrethe Nørlund Bohr menikah pada tahun 1912, dan salah satu putra mereka, Aage Niels Bohr, tumbuh menjadi seorang fisikawan yang penting pada tahun 1975 juga menerima hadiah Nobel. Bohr telah digambarkan sebagai salah satu fisikawan paling berpengaruh abad ke-20.
Niels Henrik David Bohr (7 Oktober 1885 – 18 November 1962) adalah seorang fisikawan Denmark yang membuat kontribusi yang mendasar untuk memahami atom struktur dan mekanika kuantum, di mana ia menerima Penghargaan Nobel dalam Fisika pada tahun 1922. Bohr dibimbing dan berkolaborasi dengan banyak fisikawan top abad di institut di Kopenhagen. Ia juga bagian dari tim ahli fisika yang bekerja di Proyek Manhattan. Margrethe Nørlund Bohr menikah pada tahun 1912, dan salah satu putra mereka, Aage Niels Bohr, tumbuh menjadi seorang fisikawan yang penting pada tahun 1975 juga menerima hadiah Nobel. Bohr telah digambarkan sebagai salah satu fisikawan paling berpengaruh abad ke-20.Pada tahun 1912, pakar fisika Denmark bernama Neils Bohr memperbaiki kegagalan atom Rutherford melalui percobaannya tentang spektrum atom hidrogen. Percobaannya ini berhasil memberikan gambaran keadaan elektron dalam menempati daerah disekitar inti atom. Penjelasan Bohr tentang atom hidrogen melibatkan gabungan antara teori klasik dari Rutherford dan teori kuantum dari Planck, diungkapkan dengan empat postulat, sebagai berikut :
1. Hanya ada seperangkat orbit tertentu yang diperbolehkan bagi satu elektron dalam atom hidrogen. Orbit ini dikenal sebagai keadaan gerak stasioner (menetap) elektron dan merupakan lintasan melingkar disekeliling inti.
2. Selama elektron berada dalam lintasan stasioner, energi elektron tetap sehingga tidak ada energi dalam bentuk radiasi yang dipancarkan maupun diserap.
3. Elektron hanya dapat berpindah dari satu lintasan stasioner ke lintasan stasioner lain. Pada peralihan ini, sejumlah energi tertentu terlibat, besarnya sesuai dengan persamaan planck, ΔE = hv.
4. Lintasan stasioner yang dibolehkan memilki besaran dengan sifat-sifat tertentu, terutama sifat yang disebut momentum sudut. Besarnya momentum sudut merupakan kelipatan dari h/2 ∏ atau nh/2 ∏, dengan n adalah bilangan bulat dan h tetapan planck.
Menurut model atom bohr, elektron-elektron mengelilingi inti pada lintasan-lintasan tertentu yang disebut kulit elektron atau tingkat energi. Gambarnya :
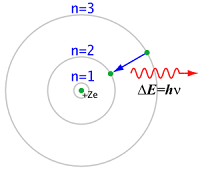
Kelebihan dalam teori atom Niels Bohr
Atom Bohr adalah bahwa atom terdiri dari beberapa kulit untuk tempat berpindahnya elektron.
Kekurangan dalam teori atom Niels Bohr
Model atom ini adalah tidak dapat menjelaskan efek Zeeman dan efek Strack
Tidak ada komentar:
Posting Komentar